
국내에서 신종 코로나바이러스 감염증(코로나19) 백신을 맞은 뒤 이상반응이 의심된다며 보건당국에 신고한 사례가 1천여 건 늘었다.
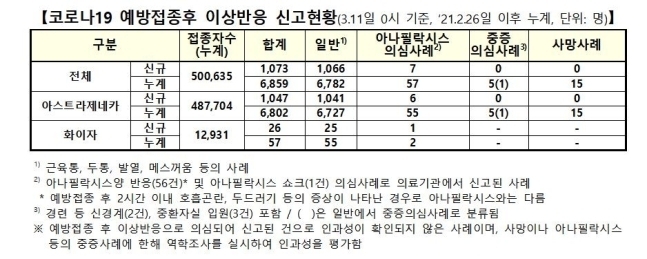
11일 코로나19 예방접종대응추진단(추진단)에 따르면 이날 0시 기준 백신 접종 후 신규 이상 반응으로 신고된 사례는 총 1천73건으로 집계됐다. 추가 사망 신고는 없었다. 현재까지 신고된 사망 사례는 누적 15명이다.
사망과 백신 접종 간 인과성은 아직 확인되지 않았다. 앞서 추진단은 지난 7일 열린 '예방접종 피해조사반' 회의 검토 결과 기보고된 사망 사례 8명에 대해 "접종 후 이상반응과 사망과의 인과성이 인정되기 어려운 경우로 잠정적으로 판단했다"고 밝힌 바 있다.
중증 전신 알레르기 반응인 '아나필락시스' 의심 사례는 7건 더 늘었다. 이 중 아스트라제네카 백신 관련이 6건, 화이자 백신 관련이 1건이다. 나머지 1천66건은 두통, 발열, 메스꺼움, 구토 등 비교적 가벼운 증상으로 신고된 사례다.
이로써 지난달 26일 백신 접종이 시작된 이후 국내 이상반응 의심 신고는 누적 6천859건으로 늘었다. 이날 0시 기준 국내 누적 접종자 50만635명의 1.37% 수준이다.
이상반응 신고를 백신 종류별로 구분해보면 아스트라제네카(AZ) 백신 관련이 6천802건으로, 전체의 99.2%를 차지했다. 화이자 백신 관련 신고는 57건(0.8%)이다. 이는 아스트라제네카 백신 접종자(48만7천704명)가 화이자 백신 접종자(1만2천931명)보다 월등히 많은 데 따른 것으로 보인다.
현재까지 신고된 경증 이외의 이상반응 사례를 유형별로 나눠보면 아나필락시스 의심 사례는 누적 57건(아스트라제네카 55건, 화이자 2건), 경련이나 중환자실 입원을 포함한 중증 의심 사례는 5건, 사망 사례는 15명이다.
아나필락시스 의심 사례는 크게 아나필락시스, 아나필락시스 쇼크, 아나필락시스양 반응으로 나뉜다. 현재까지 신고된 57건 중에서 아나필락시스양 반응이 56건, 아나필락시스 쇼크가 1건이다.
아나필락시스양 반응은 접종 후 2시간 이내 호흡곤란·두드러기 등의 증상이 나타난 경우로, 증상만 보면 아나필락시스와 유사하지만 대증요법으로 호전될 수 있어 크게 문제 되지 않는다는 게 전문가 설명이다. 그 밖에 전체 이상반응 신고의 98.8%에 해당하는 6천782건은 예방접종을 마친 뒤 흔히 나타날 수 있는 근육통, 두통, 발열, 메스꺼움 등 경증 사례였다고 추진단은 전했다.
한편 이번 달부터 만 65세 이상 요양병원·요양시설 종사자와 입원·입소자들도 아스트라제네카 백신을 맞는다. 추진단은 이날 이 같은 내용의 아스트라제네카 백신 후속 접종계획을 발표했다.
이에 따라 요양병원과 요양시설의 만 65세 이상 입원·입소자와 종사자 약 37만6천명도 이달 중 백신을 접종받는다. 1차 접종 뒤 코로나19에 확진된 사람에게는 2차 접종을 시행하고, 1차 접종 후 아나필락시스 반응을 보인 사람에 대해서는 2차 접종을 시행하지 않는다는 내용도 확정됐다.
[본 채널은 VOA 뉴스와 연합뉴스와 콘텐츠 이용계약을 맺었으며, VOA 뉴스와 연합뉴스 콘텐츠는 본 채널의 편집방향과 무관합니다.]
공데일리는 여러분의 소중한 제보를 기다립니다.
'사실, 진실, 정론'을 널리 알릴 수 있도록 아래의 메일로 많은 제보와 참여 부탁드립니다.
hoon.lee@gongdaily.com




